تاریخ بروزرسانی : 1402/07/11
سرفصل های درس شیمی پایه (شیمی آلی،معدنی،تجزیه و فیزیک)


نام بسته : درس شیمی پایه
————————————————————————
فهرست
فصل اول –شیمی آلی
ساختار و خواص
متان
آلکانها
شیمی فضاییI
الکیل هالیدها
الکل ها و اترها
نقش حلال
آلکنها I
آلکنها II
شیمی فضایی II
فصل دوم– شیمی فیزیک
ترمودینامیک
قانون اول ترمودینامیک
قانون دوم ترمودینامیک
توابع ترمودینامیکیِ استاندارد واکنش
تعادل واکنش در مخلوطهای گاز ایدهآل
گازهای حقیقی
محلولها
محلولهای غیر ایدهآل
فصل سوم – شیمی تجزیه
ماهیت شیمی تجزیه
ابزار شیمی تجزیه
کاربرد کاربرگها در شیمی تجزیه
محاسبات به کار گرفته شده در شیمی تجزیه
خطاها در تجزیههای شیمیایی
نمونهبرداری، استاندارد کردن و درجهبندی
حل مسائل تعادلی برای سیستمهای پیچیده
روشهای وزنی تجزیه
روشهای حجمی؛ تیتراسیونهای رسوبی
تیتراسیونهای خنثی شدن
کاربردهای تیتراسیون خنثی شدن
فصل چهارم– شیمی معدنی
مبانی شیمی معدنی
از جدول تناوبی تا مولکولها
گروهها
نظریه گروه و تقارن در شیمی
پیوندهای شیمیایی ـ نظریههای پیوندی
جامدهای بلوری ـ کووالانسی، یونی، فلزی و برهمکنشهای ضعیف
پیوندهای شیمیایی متفاوت از دیدگاه ساده
منابع ومآخذ
بخش هایی از بسته درس شیمی پایه
برای دریافت نسخه کامل بسته درس شیمی پایه به شماره 09306406058 پیام دهید.
ساختار و خواص
شیمی آلی
ترکیبهای شیمیایی را، بسته به اینکه از چه محلی منشاء گرفته باشند، به دو طبقه غیر آلی و آلی تقسیم میکردند. ترکیبهای غیرآلی، ترکیبهایی بودند که از مواد معدنی به دست میآمدند؛ ترکیبهای آلی، ترکیبهایی بودند که از منابع گیاهی یا حیوانی، یعنی از مواد تولید شده به وسیله اورگانیسمهای زنده، به دست میآمدند. در حقیقت، تا حدود سال 1950، بسیاری از شیمیدانها تصور میکردند که ترکیبهای آلی باید در اورگانیسمهای زنده به وجود آیند و در نتیجه، هرگز نمیتوان آنها را از مواد غیرآلی تهیه کرد.
ترکیبهایی که از منابع آلی به دست میآمدند، یک چیز مشترک داشتند: همه آنها دارای عنصر کربن بودند. حتی بعد از آنکه روشن شد این ترکیبها الزاماً نباید از منابع زنده به دست آیند، بلکه میتوان آنها را در آزمایشگاه نیز تهیه کرد، بهتر آن دیدند که برای توصیف آنها و ترکیبهایی مانند آنها، همچنان از واژه آلی استفاده کنند. تقسیم ترکیبها به غیرآلی و آلی تا به امروز همچنان محفوظ مانده است.
دو منبع بزرگ مواد آلی وجود دارد که ترکیبهای آلی ساده از آن به دست میآیند: نفت و زغالسنگ. (هر دو منبع، به معنی قدیمی خود «آلی»اند، زیرا فرآوردههای تجزیه و فساد گیاهان و جانوران به شمار میآیند.) این ترکیبهای ساده به عنوان مواد ساختمانی اولیه مورد استفاده قرار میگیرند و با کمک آنها میتوان ترکیبهایی بزرگتر و پیچیدهتر را تهیه کرد.
نفت و زغالسنگ، به عنوان سوختهای فسیلی، باقی مانده از هزاران سال و تجدیدنشدنی هستند.
شمار ترکیبهای کربندار چندین برابر ترکیبهایی است که کربن ندارند. این ترکیبهای آلی را به خانوادههایی تقسیم میکنند که معمولاً در ترکیبهای غیرآلی، همانندی برایشان وجود ندارد.
بعضی از مولکولهای شناخته شده آلی، هزاران اتم دارند و آرایش اتمها حتی در مولکولهای نسبتاً کوچک ممکن است بسیار پیچیده باشد. یکی از دشواریهای اساسی شیمی آلی، یافتن چگونگی آرایش اتمها در مولکولها، یعنی تعیین ساختار این ترکیبهاست.
راههای زیادی برای خرد کردن مولکولهای پیچیده، یا نوآرایی آنها، به منظور تشکیل مولکولهای تازه، وجود دارد؛ راههای زیادی برای افزودن اتمهای دیگر به این مولکولها، یا جانشین کردن اتمهای تازه به جای اتمهای پیشین، وجود دارد.
اتمهای کربن میتوانند به یکدیگر متصل شوند. گستره اتصال آنها بهم به اندازهای است که برای اتمهای هیچیک از عناصر دیگر ممکن نیست. اتمهای کربن میتوانند زنجیرهایی به طول هزارها اتم، یا حلقههایی با ابعاد گوناگون تشکیل دهند؛ این زنجیرها و حلقهها ممکن است شاخهدار و دارای پیوندهای عرضی باشند. به اتمهای کربن در این زنجیرها و حلقهها، اتمهای دیگری، به ویژه هیدروژن، همچنین فلوئور، کلر، برم، ید، اکسیژن، نیتروژن، گوگرد، فسفر، و سایر اتمها متصل میشوند.
هر آرایش متفاوتی از اتمها با یک ترکیب معین تطبیق میکند و هر ترکیب دارای مجموعهای از ویژگیهای شیمیایی و فیزیکی مخصوص به خود است. شیمی آلی زمینهای است که از دیدگاه تکنولوژی اهمیت فوقالعاده دارد: شیمی آلی شیمی رنگ و دارو، کاغذ و مرکب، رنگینهها و پلاستیکها، بنزین و لاستیک چرخ است؛ شیمی آلی شیمی غذایی است که میخوریم و لباسی است که میپوشیم.
زوج دانشجوی دکتری شیمی از پایاننامه خود دفاع کردند
نظریه ساختاری
تئوری ساختاری مبنایی است که با تکیه بر آن میلیونها مفهوم درباره صدها هزار ترکیب در یکجا گردآمده و به گونهای مدون نظم گرفتهاند. تئوری ساختاری مبنایی است که با تکیه بر آن میتوان این مفاهیم را تبیین کرد و فهمید.
تئوری ساختاری چهارچوب افکاری است که نشان میدهد چگونه اتمها گرد هم جمع میشوند و مولکولها را میسازند. تئوری ساختاری درباره چگونگی ترتیب اتصال اتمها به یکدیگر، و درباره الکترونهایی که اتمها را به یکدیگر متصل نگه میدارند، بحث میکند. تئوری ساختاری درباره شکل و اندازه مولکولهایی که از این اتمها تشکیل میشوند و درباره چگونگی توزیع الکترونها بر روی آنها بحث میکند.
یک مولکول را اغلب با یک تصویر یا یک الگو ـ و گاهی با چندین تصویر و چندین الگو ـ نمایش میدهند. هستههای اتمی را با حروف یا گلولههای پلاستیکی و الکترونهای پیوند دهنده آنها را با خطوط یا نقطه یا رابطهای پلاستیکی نمایش میدهند. این تصاویر و الگوهای خام هنگامی سودمندند که آنچه را که میخواهند به ما بگویند، بفهمیم. اگر این تصویرها و الگوها، با تکیه بر تئوری ساختاری تبیین شوند، اطلاعات زیادی درباره ترکیبی که مولکولهایش به وسیله آنها نمایش داده میشوند، در اختیار میگذارند: چگونه مولکول را بسازیم، خواص فیزیکی مورد انتظار از آن کدامند ـ دمای ذوب، دمای جوش، سنگینی ویژه، نوع حلالهایی که این ترکیب در آنها حل میشود، حتی رنگی بودن یا رنگی نبودن آن، خواص شیمیایی مورد انتظار از آن کدامند. نوع واکنشگرهایی که این ترکیب با آنها وارد واکنش میشود و نوع فراوردههایی که تشکیل خواهد شد، آیا این ترکیب با سرعت واکنش میدهد یا آهسته. ما میتوانیم تمام این اطلاعات را درباره ترکیبی که پیش از این هرگز با آن برخورد نداشتهایم، به سادگی با تکیه بر فرمول ساختاری آن، و آنچه که از فرمول ساختاری آن درک میکنیم، به دست آوریم.
مکانیک کوانتومی (Quantum mechanics)
یک معادله موج، یک سری راهحل دارد که تابعهای موج نامیده میشوند و هر یک با یک تراز انرژی متفاوت برای الکترون تطبیق میکند. اجزای عملیات ریاضی، حتی برای سادهترین سیستمها، به اندازهای وقتگیر است که در حال حاضر فقط راهحلهای تقریبی را میتوان به دست آورد ـ البته کامپیوترهای فوق سریع روزی این وضعیت را تغییر خواهند داد. حتی در شرایط موجود، مکانیک کوانتومی پاسخهایی به دست میدهد که با واقعیتها بخوبی سازگارند و امروزه به عنوان سودمندترین روش برای درک ساختار اتمی و مولکولی پذیرفته شده است.

اوربیتالهای اتمی
یک معادله موج نمیتواند دقیقاً به ما بگوید که یک الکترون در یک لحظه معین در کجاست، یا با چه سرعتی حرکت میکند؛ این معادله به ما امکان نمیدهد که مدار مشخص و دقیقی برای الکترون در اطراف هسته رسم کنیم. بجای آن، احتمال یافتن الکترون را در یک مکان معین به ما میگوید.
ناحیهای از فضا را که احتمال یافتن الکترون در آن وجود دارد، اوربیتال مینامند. انواع گوناگونی از اوربیتال وجود دارد که شکل و اندازههای متفاوت دارند و به شکلهای ویژه در اطراف هسته آرایش میگیرند. نوع اوربیتالی که یک الکترون اشغال میکند، به انرژی الکترون بستگی دارد. شکل این اوربیتالها و آرایش آنها نسبت به یکدیگر برای ما اهمیت ویژه دارد، زیرا شکل و آرایش اوربیتالها آرایش فضایی اتمها را در یک مولکول تعیین میکند ـ یا دقیقتر، میتوان تصور کرد که تعیینکننده است ـ و حتی رفتار شیمیایی آن را زیر کنترل دارند.
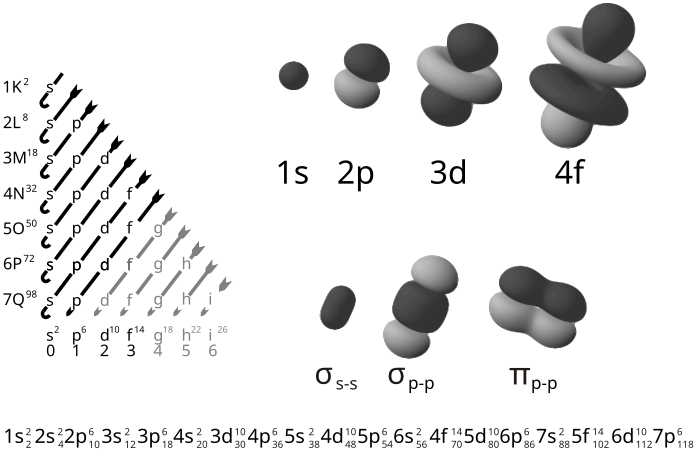
اجازه بدهید ببینیم بعضی از اوربیتالهای اتمی چه شکلی دارند. اوربیتالی را که در پایینترین تراز انرژی قرار دارد، اوربیتال s1 مینامند. این اوربیتال، کروی است و هسته اتم در مرکز آن قرار دارد. محدوده یک اوربیتال کاملاً مشخص نیست زیرا این احتمال، هرچند بسیار کوچک، وجود دارد که الکترون کاملاً از اتم جدا شود ـ یا حتی آن را بر روی اتم دیگری بیابیم! با وجود این، احتمال یافتن الکترون بعد از فاصله معینی از هسته به سرعت کاهش مییابد.
در تراز انرژی بالاتر، اوربیتال s2 قرار دارد. این اوربیتال نیز کروی و مرکز آن بر هسته اتم منطبق است. این اوربیتال ـ به طور طبیعی ـ بزرگتر از اوربیتال s1 است: انرژی بالاتر (پایدار کمتار) آن از بزرگتر بودن فاصله میانگین بین الکترون و هسته ناشی میشود که در نتیجه، جاذبه الکتروستاتیکی موجود را کاهش میدهد.
بعد، سه اوربیتال با انرژی برابر موسوم به اوربیتالهای p2 وجود دارد، اوربیتالهای p2 دمبلی شکلاند. هر اوربیتال p2 دارای دو لوب است و هسته اتم بین آنها قرار دارد. محور هر اوربیتال p2 عمود بر محورهای دو اوربیتال دیگر است. این اوربیتالها با نامهای px2، py2 و pz2 از یکدیگر متمایز میشوند، x، y و z به محورهای مربوط اشاره دارند.
آرایش الکترونی ـ اصل طرد پاولی
تعدادی «قاعده» وجود دارد که چگونگی توزیع الکترونها را در یک اتم تعیین میکند، یعنی تعیینکننده آرایش الکترونی یک اتم است. اساسیترین این قواعد اصل طرد پاولی است: فقط دو الکترون میتوانند یک اوربیتال اتمی را اشغال کنند و برای این منظور، این دو الکترون باید اسپینهای مخالف داشته باشند. میگویند این دو الکترون، با اسپینهای مخالف، جفت شدهاند. الکترونهای با اسپین یکسان تمایل دارند، تا آنجا که امکان داشته باشد، از یکدیگر فاصله بگیرند. این تمایل مهمترین عامل در تعیین شکل و خواص مولکولهاست.
یک اوربیتال فقط هنگامی به وسیله دو الکترون اشغال میشود که سایر اوربیتالهای همانرژی (مثلاً اوربیتالهای p2) هر یک به وسیله یک الکترون اشغال شده باشند. الکترونهای s1، نخستین لایه دو الکترونی را تشکیل میدهند، و الکترونهای s2 و p2 دومین لایه هشت الکترونی را میسازند. برای عناصری که بعد از ده عنصر نخست قرار میگیرند، لایه سومی وجود دارد که شامل اوربیتال s3، اوربیتالهای p3 و همینطور تا آخر است.
اوربیتالهای مولکولی
در مولکولها، مانند اتمهای مجزا، الکترونها اوربیتالها را بر طبق همان «قواعد» پیشین اشغال میکنند. این اوربیتالهای مولکولی را به صورت متمرکز در اطراف چندین هسته و شاید دربرگیرنده تمامی مولکول، در نظر میگیرند؛ توزیع هستهها و الکترونها به صورتی است که پایدارترین مولکول ممکن از آن نتیجه شود.
برای آنکه معادلههای بسیار پیچیده ریاضی بیشتر قابل استفاده باشند، معمولاً از دو فرض سادهکننده بهره میگیرند: (الف) هر جفت الکترون اساساً در نزدیکی دو هسته مستقر میشوند، و (ب) شکل این اوربیتالهای مولکولی مستقر و موضع آنها نسبت به یکدیگر، به صورت ساده، وابسته به شکل و موضع اوربیتالهای اتمی در اتمهای سازنده است.
فرض دوم که به رابطه موجود بین اوربیتالهای اتمی و مولکولی مربوط میشود، و در بخش بعدی مورد بحث قرار گرفته، یک فرض بسیار منطقی است. این فرض به اندازهای سودمند بوده است که هر زمان لازم باشد، اوربیتالهای اتمی از انواع معین اختراع میشود تا این فرض همچنان معتبر باقی بماند.
پیوند کووالانسی
برای تشکیل یک پیوند کووالانسی، دو اتم را باید در وضعیتی قرار داد که اوربیتال یکی با اوربیتال دیگری همپوشانی کند؛ هر اوربیتال باید یک الکترون داشته باشد. وقتی این کار انجام شود، دو اوربیتال اتمی درهم میآمیزند و یک اوربیتال پیوندی که به وسیله هر دو الکترون اشغال میشود، تشکیل میدهند. دو الکترونی که یک اوربیتال پیوندی را اشغال میکنند، باید دارای اسپینهای مخالف باشند، یعنی باید جفت شده باشند. هر الکترون به تنهایی تمام اوربیتال پیوندی را در اختیار میگیرد و بنابراین، میتوان تصور کرد که به هر دو هسته «تعلق» دارد.
این نوع آرایش الکترونها و هستهها انرژی کمتری دارد ـ یعنی، پایدارتر از آرایش الکترونها و اتمها در اتمهای مجزاست؛ در نتیجه، تشکیل پیوند با آزاد شدن انرژی همراه است. مقدار انرژی آزاد شده (به ازاء هر مول) به هنگام تشکیل یک پیوند (یا مقدار انرژی لازم برای شکستن این پیوند) را انرژی تفکیک پیوند مینامند. در مورد یک جفت اتم معین، هر اندازه همپوشانی اوربیتالهای اتمی بیشتر باشد، پیوند تشکیل شده محکمتر است.
همپوشانی اوربیتالهای اتمی به این معنی است که اوربیتال پیوندی همان محدودهای را در فضا اشغال میکند که پیش از این به وسیله هر دو اوربیتال اتمی اشغال شده بود. در نتیجه، یک الکترون از یک اتم میتواند، تا اندازهای قابل توجه، در همان محل مناسب پیشین، نسبت به هسته «خود» باقی بماند و در عین حال، محل نسبتاً مناسبی را نیز نسبت به هسته دوم اشغال کند؛ البته این مطلب در مورد الکترون دیگر نیز درست است.
اندازه مولکول هیدروژن به مقدار قابل توجهی کوچکتر از حجم یک اتم هیدروژن تنهاست. اگرچه نخست شگفتانگیز به نظر میرسد، این انقباض ابر الکترونی، در واقع همان چیزی است که انتظار میرود. جذب شدید الکترونها به وسیله دو هسته، موجب میشود که مولکول پایدارتر از اتمهای هیدروژن مجزا باشد؛ این مطلب باید به این معنی باشد که الکترونها در مولکول، نسبت به اتمها، محکمتر و نزدیکتر به هسته نگهداری میشوند.
اعطای جایزه «دکتر محمدرضا سعیدی» به دو دانشجوی شیمی دانشگاه شریف
اوربیتالهای هیبرید: sp
اکنون اجازه بدهید بریلیم کلرید، 2BeCl، را مورد توجه قرار بدهیم.
بریلیم الکترون جفت نشده ندارد. چگونه میتوانیم ترکیب شدن آن را با دو اتم کلر تبیین کنیم؟ تشکیل پیوند، فرایندی انرژیزا (پایدارکننده) است، و تمایل به تشکیل پیوند ـ تا سرحد امکان ـ وجود دارد، حتی اگر این عمل به اوربیتالهایی نیاز داشته باشد که به اوربیتالهای اتمی پیش گفته، شباهتی نداشته باشند. اگر بخواهیم روش ساخت تخیلی مولکولی در اینجا کارایی داشته باشد، باید آن را تغییر بدهیم. باید نوعی اتم بریلیم خیالی اختراع کنیم، که بتواند با دو اتم کلر پیوند برقرار کند.
برای رسیدن به اتم بریلیم دوظرفیتی، اجازه بدهید کمی با الکترونها بازی کنیم. نخست، یکی از الکترونهای s2 را به یک اوربیتال خالی p «منتقل» میکنیم:
این کار دو الکترون جفت نشده فراهم میآورد که برای تشکیل پیوند با دو اتم کلر ضرورت دارند. اکنون انتظار داریم که بریلیم با استفاده از اوربیتال p، یک نوع پیوند و با استفاده از اوربیتال s یک پیوند از نوع دیگر تشکیل دهد. دوباره، این مطلب مغایر با واقعیت است: معلوم شده که دو پیوند موجود در بریلیم کلرید همارزند.
بنابراین، اکنون این اوربیتالها را با هم میآمیزیم. از دیدگاه ریاضی، ترکیبهای گوناگونی از یک اوربیتال s و یک اوربیتال p انتخاب میشوند و اوربیتالهای مخلوط (هیبری)، که خصلت جهتداری در آنها در بالاترین حد ممکن است به دست میآیند. از محاسبات ریاضی سه نتیجه پراهمیت به دست میآید:
(الف): «بهترین» اوربیتال هیبرید خیلی بیشتر از اوربیتال s یا p جهتدار است؛ (ب) این دو اوربیتال بهینه دقیقاً با یکدیگر همارزند؛ و (ج) این اوربیتالها دقیقاً در دو جهت مخالف قرار میگیرند ـ این آرایش به آنها اجازه میدهد که تا سرحد امکان از یکدیگر فاصله بگیرند . بنابراین، زاویه موجود بین این اوربیتال 180 درجه است.
این نوع اوربیتالهای هیبرید را اوربیتال sp مینامند، زیرا از اختلاط یک اوربیتال s و یک اوربیتال p به وجود آمدهاند.
برای دریافت نسخه کامل این بسته درسی به شماره 09306406058 پیام دهید.
اوربیتالهای هیبرید 2sp
اکنون، اجازه بدهید به بور تری فلوئورید، 3BF، نگاه کنیم. بور یک الکترون جفت نشده دارد که اوربیتال p2 را اشغال میکند. برای تشکیل سه پیوند، به سه الکترون جفت نشده نیاز داریم.
بنابراین، یکی از الکترونهای s2 را به یک اوربیتال p2 منتقل میکنیم:
اگر اکنون بخواهیم بر اساس درس شیمی پایه پایدارترین مولکول ممکن را «بسازیم» باید محکمترین پیوندهای ممکن را تشکیل دهیم؛ برای این کار باید، تا آنجا که میتوانیم، اوربیتالهای اتمی جهتدارتری به وجود آوریم. باز هم هیبریداسیون یک چنین اوربیتالهایی: یعنی سه اوربیتال هیبرید دقیقاً همارز با یکدیگر، را به وجود میآورد.
این اوربیتال هیبرید را اوربیتال 2sp مینامند، زیرا از اختلاط یک اوربیتال s با دو اوربیتال p به وجود آمدهاند. این اوربیتالها در یک صفحه، که هستههای اتمی را نیز دربر میگیرد، قرار دارند و به سوی گوشههای یک مثلث متساویالاضلاع جهت گرفتهاند؛ بنابراین، زاویه موجود بین اوربیتالها °120 است. باز هم میبینیم که این آرایش هندسی ـ در این مورد آرایش مثلثی (سه گوشه) ـ به اوربیتالها اجازه میدهد، که تا سرحد امکان، از یکدیگر فاصله بگیرند.
اوربیتالهای هیبرید 3sp
اکنون اجازه بدهید به یکی از سادهترین مولکولهای آلی، یعنی متان، 4CH، توجه کنیم.
کربن در هر یک از دو اوربیتال p خود دارای یک الکترون جفت نشده است، و بنابراین، میتوان انتظار داشت که ترکیب 2CH را تشکیل دهد. (چنین ترکیبی تشکیل میشود، ولی 2CH یک مولکول
شدیداً واکنشپذیر است و خواص آن در حول نیاز کربن به تشکیل دو پیوند دیگر دور میزند.) باز هم تمایل به تشکیل پیوند بیشترین تعداد پیوند ـ در این مورد، ترکیب شدن کربن با چهار اتم هیدروژن ـ را ملاحظه میکنیم.
برای فراهم آوردن چهار الکترون جفت نشده، یکی از الکترونهای s2 را به اوربیتال خالی p منتقل میکنیم:
باز هم جهتدارترین اوربیتالها، اوربیتالهای هیبرید هستند: این بار، اوربیتالهای 3sp از اختلاط یک اوربیتال s و سه اوربیتال p به وجود میآیند.
از همپوشانی هر یک از اوربیتالهای 3sp کربن با اوربیتال s1 هیدروژن، متان به وجود میآید: یعنی کربن در مرکز یک چهاروچهی منظم و چهار هیدروژن در گوشههای آن.
به این ترتیب، در سه بخش اخیر، دیدیم که نه تنها طول پیوند و انرژی تفکیک پیوند از ویژگیهای وابسته به پیوندهای کووالانسیاند، بلکه زوایای پیوندی نیز از ویژگیهای آن به شمار میروند. زوایای پیوندی را به آسانی میتوان به آرایش اوربیتالهای اتمی ـ از جمله اوربیتالهای هیبرید ـ که در تشکیل پیوند مشارکت میکنند، ربط داد؛ زوایای پیوندی، در نهایت، به اصل طرد پاولی و تمایل الکترونهای جفت نشده به داشتن بیشترین فاصله ممکن از یکدیگر، باز میگردد.
برخلاف پیوند یونی، که استحکام آن در تمام جهات یکسان است، پیوند کووالانسی یک پیوند جهتدار است. اکنون به تدریج میفهمیم که چرا شیمی پیوند کووالانسی تا این حد به شکل و اندازه مولکول بستگی دارد.

برای مشاوره اینجا بزنید

| |
نوشتههای تازه





















































من میخوام کنکور دکتری شرکت کنم
میشه راهنماییم کنید
سلام و عرض ادب
جهت دریافت مشاوره تحصیلی برای آزمون دکتری و دریافت 10% منابع دکتری و سرفصل های پرتکرار به شماره 09306406058 پیام دهید یا روی لینک زیر بزنید:
ارسال پیام به شماره 09306406058
در هرصورت شما میتوانید در اینستاگرام هم به اخبار آزمون دکتری و مشاوره دسترسی داشته باشید:
برای دیدن صفحه رسمی phdphd.org در اینستاگرام کلیک کنید.
تیم پشتیبانی پایگاه دکتری
چقد عالیه
مرسی